医学部生物医学工程学院董海峰教授在寻求高度靶向和高效抗癌症治疗方面取得重要研究进展,成果报道在学术期刊Angewandte Chemie International Edition上,标题为“Near-Infrared Light-Triggered Cascade Nanosystems for Spatiotemporally Controlled Gene-Silencing and Gas Synergistic Cancer Therapy”。该工作以课题组在核酸设计方面的积累为研究基础,结合转换纳米材料技术与肿瘤生物学,实现了时空可控的抗肿瘤联合治疗。我院博士后程亚如为第一作者,董海峰教授为通讯作者。

DNAzymes能够特异性识别和切割特异性癌基因靶点,从而阻断基因沉默治疗中的蛋白质翻译。由于其生物相容性、易于合成和高可编程性,DNAzymes在病毒感染、肿瘤和其他疾病的基因治疗中得到了广泛的探索。然而,基于DNAzymes的基因治疗应用的一个主要瓶颈是,如何实现基因沉默的时空可控性。本研究开发了一种近红外光(NIR)触发的级联纳米系统,实现了级联效应介导的气体-基因协同治疗,并证明了这种纳米平台在体外和体内均表现出良好的联合抗肿瘤作用。该纳米系统通过将上转换纳米颗粒(UCNPs)与一氧化氮(NO)前体结合,进一步利用静电作用吸附具有apurinic/apyrimidinic endonuclease 1(APE1)酶激活能力的DNAzymes。UCNPs作为光转换器,在NIR光照射下激发NO前体产生NO,而产生的NO不仅直接参与气体治疗,还将诱导细胞质中APE1水平的上调,从而增强DNAzymes的激活和时空可控的基因沉默。通过利用这一机制,将NIR光控制的NO释放和APE1激活的基因治疗的结合,实现了级联效应介导的气体-基因协同治疗。
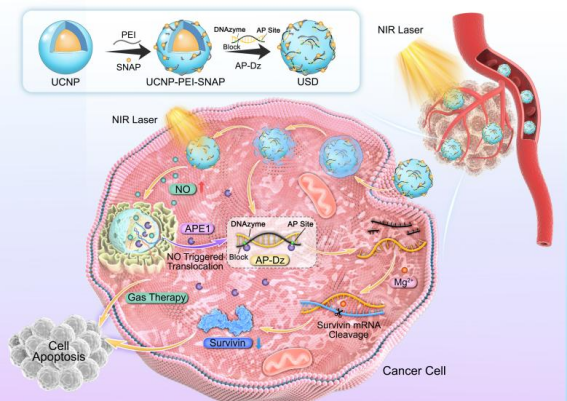
图1.近红外激活的级联纳米平台的构建及其在抗肿瘤中的作用机制
该研究得到了国家重大研究计划项目,国家自然科学基金,深圳市医学研究专项资金项目,广东省珠江团队项目和中国博士后科学基金等项目的资助。
原文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/anie.202422375
撰稿:程亚如 审核:陆敏华