2024年11月,深圳大学医学部卡尔森国际肿瘤中心朱卫国特聘教授团队在《Cell Death & Differentiation》(影响因子12.4,TOP期刊,中科院一区)发表题为“hnRNPA2B1 deacetylation by SIRT6 restrains local transcription and safeguards genome stability”的研究论文,阐明了RNA结合蛋白hnRNPA2B1的去乙酰化修饰对于DNA损伤时局部转录抑制以及基因组稳定性的维持起到至关重要的作用。博士研究生陈凤,硕士研究生许文超为本研究共同第一作者,医学部张俊助理教授和朱卫国特聘教授为本文共同通讯作者。

众所周知,DNA双链的断裂会使细胞发生快速和短暂的转录沉默,这一行为有利于为DNA损伤修复提供时间和空间、减少转录-复制冲突以及避免受损的DNA转录生成异常mRNA。因此,DNA损伤周围转录活性的精确调节对于保持基因组稳定性和控制转录过程至关重要,特别是当损伤发生在活跃转录基因附近。然而,目前人们对于转录抑制过程的具体机制,以及它是如何最终达到维持基因组稳定性的目的,尚不完全清楚。
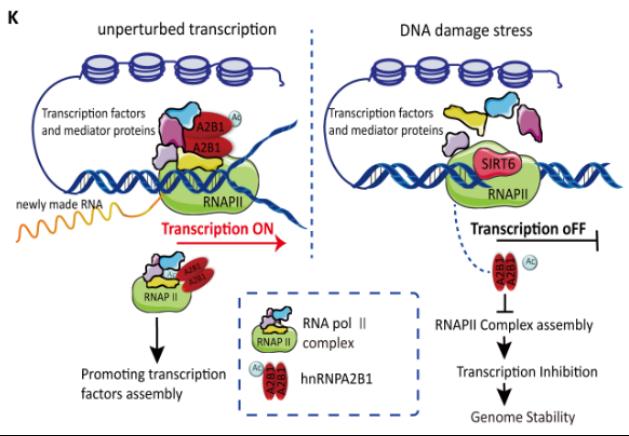
本研究揭示了RNA结合蛋白hnRNPA2B1作为一个关键的转录相关因子在正常情况下对于维持转录复合物的稳定性至关重要。然而,当DNA损伤发生时,hnRNPA2B1会脱离损伤位点,并进一步降低RNA聚合酶Ⅱ复合物的组装效率,从而导致局部的转录抑制。机制上,该团队鉴定出SIRT6使hnRNPA2B1在K113/173残基上发生去乙酰化使其快速脱离DNA损伤位点,这一行为破坏了活跃染色质上RNA聚合酶Ⅱ复合物的完整性。功能研究显示,hnRNPA2B1去乙酰化或缺失有利于DSB修复,且乙酰化模拟物对基因毒性疗法更加敏感。这一事实提示可以通过抑制SIRT6活性来减少hnRNPA2B1在DNA损伤位点的脱离以增强某些特定肿瘤细胞对放化疗的敏感性。这一研究结果为深入理解转录抑制在基因组稳定性维持过程中的具体机制提供了新思路,并为探索针对hnRNPA2B1异常表达癌症的治疗提供了潜在新策略(具体工作模式图如下)。
本研究得到国家自然科学基金,广东省自然科学基金以及深圳市医学研究基金等项目的资助。
原文链接:https://www.nature.com/articles/s41418-024-01412-4
撰稿:张俊 审核:朱卫国