近日,深圳大学医学部生物医学工程学院林静特聘教授团队在国际顶级学术期刊《ACS Nano》(影响因子17.1,中科院一区,TOP期刊)上发表了题为《Comprehensively Optimizing Fenton Reaction Factorsfor Anti-Tumor Chemodynamic Therapy by Charge-Reversal Theranostics》的研究论文。医学部博士后张亚杰为第一作者,林静教授为通讯作者,深圳大学为唯一完成单位。

化学动力学疗法(Chemodynamic Therapy, CDT)是一种新兴的高选择性肿瘤治疗方法,采用芬顿或类芬顿试剂催化肿瘤微环境(TME)中高表达的过氧化氢(H2O2)转化为高毒性的羟基自由基(·OH),继而引起细胞凋亡和铁死亡。瘤内芬顿反应条件直接决定了CDT的疗效,即TME中芬顿试剂的量、酸度和H2O2的浓度。如何全面优化活体芬顿反应条件是一个巨大的挑战。
本研究开发了一种电荷反转的聚合物递药系统,实现活体芬顿反应条件的全面优化,用于肿瘤增强化学动力学治疗(图1)。通过制备pH响应型聚(乙二醇)-聚(β-氨基酯)(PEG-PAE)胶束(PM),装载葡萄糖氧化酶(GOx)、亚稳态铁离子(Fe2+)和pH响应型近红外二区(NIR-II)荧光/光声探针(LET-1052),获得最终电荷反转诊疗剂(GFL@PM)。其中PEG-PAE结构单元与Fe2+形成不饱和配位,在有效稳定Fe2+的同时保留了其芬顿催化活性。当GFL@PM到达肿瘤部位,在微酸性TME内,PEG-PAE发生电荷反转阳离子化,增强了肿瘤细胞内Fe2+的蓄积,同时亲水质子化使Fe2+暴露。GFL@PM携带的GOx可以高效催化肿瘤内葡萄糖生成葡萄糖酸和H2O2,葡萄糖酸引起的pH降低进一步促进纳米药物阳离子化并为芬顿反应提供适宜的酸度,H2O2为芬顿反应提供原料。因此,芬顿反应的限制因素被全面优化,体外和体内的CDT增强效果都得到了验证。该研究为全面优化瘤内芬顿反应条件提供了理论基础和新的策略。
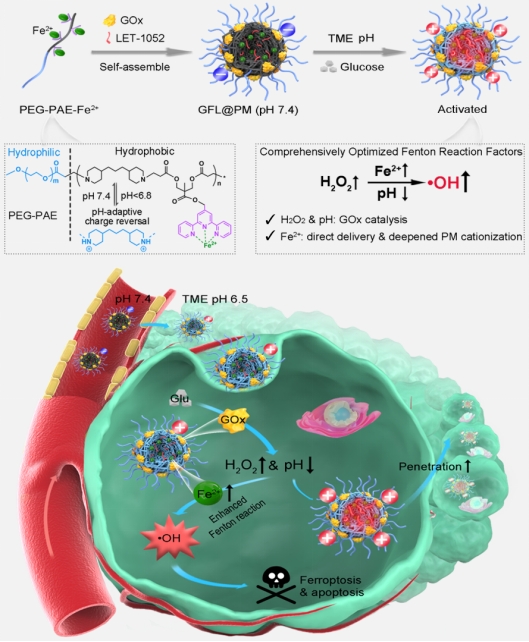
图1. 全面优化芬顿反应条件用于肿瘤增强化学动力学治疗
该研究得到了国家重点研发计划、国家自然科学基金、深圳市科技计划基础研究等项目的支持。
原文链接:https://pubs.acs.org/doi/full/10.1021/acsnano.3c03279