DNA双链断裂(double strand break,DSB)是极为严重的DNA损伤形式。如果不对其进行修复或修复错误及修复不及时,可导致基因组突变和更大范围的结构重排,引起细胞癌变或者基因组不稳定性相关疾病等。
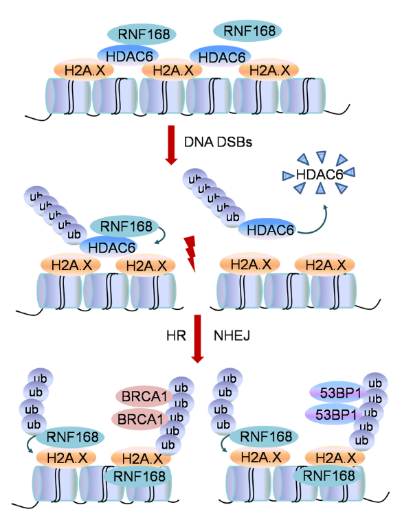
HDAC6是一种广泛表达的HDAC Ⅱb家族的组蛋白去乙酰化酶。据报道,HDAC6可作为去乙酰化酶和泛素酶参与DNA损伤中的错配修复(MMR)及核苷酸切除修复(NER)两种途径。然而,HDAC6是否参与DSB修复尚不清楚。RNF168作为一种经典的E3泛素连接酶参与调节多种泛素信号通路,RNF168催化的H2A/H2AX泛素化是DSB损伤修复中的关键步骤,其可作为平台参与下游修复因子的招募。任何调节RNF168-H2A/H2AX泛素化状态的因素,都可能影响DSB修复效率。因此,阐述其他潜在的精确调控RNF168-H2A/H2X信号轴的分子,对于了解基因组稳定性调控具有重要意义。
2023年8月,朱卫国特聘教授团队在Nuclei Acids Research(核酸研究)杂志上发表题为The HDAC6-RNF168 axis regulates H2A/H2A.X ubiquitination to enable double strand break repair的研究论文,该论文揭示了在DSB损伤修复中,HDAC6以一种酶活性非依赖的方式负调控DSB修复。
文章首先发现HDAC6同时参与DSB损伤修复中的同源重组(HR)和非同源末端链接(NHEJ)修复途径。通过进一步的机制探索,作者发现在生理条件下,HDAC6能够直接与组蛋白H2A/H2A.X结合,阻止H2A/H2A.X与E3连接酶RNF168的相互作用,进而抑制H2A.X的过度泛素化修饰。当细胞内发生DSB时,RNF168被大量招募,并迅速泛素化HDAC6的赖氨酸116位点,介导HDAC6的蛋白酶体降解,该过程进一步促进了 RNF168与H2A/H2A.X之间的相互作用。随后RNF168催化H2A/H2A.X的泛素修饰,促使DSB修复因子(包括53BP1和BRCA1)向受损染色质募集,从而精准调控DNA双链断裂修复。
综上所述,此项研究证实了核内HDAC6在DSB损伤修复中的重要作用,揭示了HDAC6-RNF168轴调控H2A/H2A.X泛素化状态的新调控机制。 在功能上,通过干扰HDAC6-RNF168-H2A/H2A.X三者之间的动态平衡可能是干扰癌细胞抵抗基因毒性损伤的关键机制,并可能为癌症治疗提供新思路。
深圳大学国际肿瘤中心主任朱卫国教授团队长期从事表观遗传学领域的研究,尤其专注组蛋白修饰或组蛋白修饰酶参与DNA损伤应答方面的研究。这次发表的研究是延续组蛋白修饰酶在DNA损伤修复机制的探索。该论文所有工作均在深圳大学完成,该团队博士生邱玲榆为第一作者,朱卫国特聘教授和张俊助理教授为论文共同通讯作者。本项工作得到了国家自然科学基金委员会,广东省科技计划,深圳市科技创新委员会以及深圳大学2035计划B类等项目支助。
详细内容见相关论文:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkad631/7232846#412326696