近日,深圳大学物理与光电工程学院生物医学光子学研究中心屈军乐教授团队在权威期刊《PhotoniX》(JCR一区TOP期刊,影响因子:16.5)发表题为“Deep tissue super-resolution imaging with adaptive optical two-photon multifocal structured illumination microscopy”的研究论文,提出并发展了一种基于自适应光学的双光子多焦点结构光照明显微成像(Two-photon multifocal structured illumination microscopy based on adaptive optics, AO 2P-MSIM)技术和系统。该技术利用双光子成像深度大的优势,使用自适应光学技术校正深层组织成像时由于样品内部折射率不均匀造成的像差,结合图像扫描显微技术提高成像分辨率,最终实现对活体细胞及组织的在体、实时动态显微成像,为脑科学、胚胎发育学、肿瘤学等研究提供技术支撑。张晨爽博士为该论文的第一作者,于斌教授、林丹樱教授和屈军乐教授为该论文的通讯作者,深圳大学为第一完成单位。
大脑是生物体内结构和功能最复杂的器官,包含着多达上千亿神经元和它们之间十万亿突触联系,从而产生了人类理解自然的强大能力,也构成了人类认识本身的最重要领域。然而,由于大脑神经网络的跨尺度复杂性以及现有成像技术的局限性,人类对大脑的探索依然处于粗浅水平。因此,创新发展活体超分辨显微成像技术,实现大深度活体脑组织的精细结构及其动态过程成像是脑科学和神经系统疾病研究的重大需求。
双光子激发荧光显微成像技术在神经科学领域发挥着重要作用。由于非线性吸收和发射的过程只发生在焦点附近很小的区域内,双光子成像具有天然的光学层析能力。此外,双光子激发显微成像使用的激发光相较于传统单光子激发光波长更长,可以穿透到更深的脑区。近年来,研究者们提出了图像扫描显微成像技术,并通过成像过程的并行化进一步提高成像速度,发展了双光子多焦点结构光照明显微成像技术(Two-photon multifocal structured illumination microscopy, 2P-MSIM)。然而由于生物组织对光的散射以及样品内部折射率不均匀造成的像差,超分辨显微成像在活体深层组织研究方面仍然面临难以克服的技术难题。
自适应光学技术是恢复深层组织成像空间分辨率和信噪比的有效方法,通常是在激发光路中放置变形镜或空间光调制器,校正像差导致的聚焦光斑弥散,以恢复焦点体积和峰值强度。变形镜的反射面是由多个驱动器控制的连续薄膜,可以避免衍射效应造成的能量损失,主要校正低阶像差。液晶空间光调制器是在激发光路中广泛使用的像差校正元件,采用了紧密排列的液晶晶体阵列,空间分辨率高,可校正高阶像差。但液晶空间光调制器的使用要求入射光为偏振光,并对波长敏感。实际上,对于深层组织的超分辨显微成像,激光光路和荧光发射光路的像差校正都是必不可少的。
本工作发展了一种基于自适应光学的双光子多焦点结构光照明显微成像(Two-photon multifocal structured illumination microscopy based on adaptive optics, AO 2P-MSIM)技术和系统(图1)。使用单个高速液晶空间光调制器代替传统的微透镜阵列和扫描振镜组合,实现多焦点激发光阵列的生成及扫描移动。同时,该液晶空间光调制器还用于校正激光光路的像差。为了进一步提高深层组织超分辨显微成像的像差校正性能,在荧光光路中放置了变形镜,以恢复受像差影响的成像分辨率。相比传统像差校正技术,本文所提出的方法分别使用液晶空间光调制器和变形镜,独立校正激光光路和荧光发射光路的像差。与仅使用液晶空间光调制器校正激光光路的像差相比,本文所提出的方法可以提高像差校正的性能。更重要的是,由于光学像差导致信噪比和分辨率严重退化,在荧光发射光路使用变形镜进行像差校正是实现深层组织超分辨显微成像的关键。
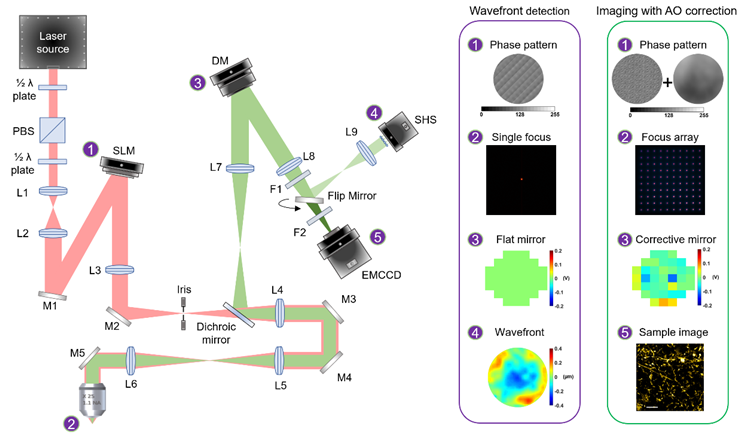
图1.基于自适应光学校正的双光子多焦点结构光照明显微成像系统示意图。L1-L9:透镜。F1和F2:滤光片。Flip mirror:翻转镜,可在超分辨成像和波前探测模式之间切换。波前探测模式:1.液晶空间光调制器(Spatial light modulator,SLM)上加载相位图;2.对应生成单个激发点;3.变形镜(Deformable mirror,DM)上加载平面镜电压面型;4.夏克哈特曼波前传感器(Shack–Hartmann wavefront sensor,SHS)探测波前像差。像差校正后的超分辨成像模式:1. SLM上加载多焦点激发光阵列的相位图和像差校正相位图;2.对应生成像差校正后的多焦点激发光阵列;3. DM上加载像差校正电压面型;4.经过像差校正的超分辨图像。
神经元通过彼此之间的突触接触交流信息,构成动物个体信息处理的神经网络,因此观察突触精细结构及其动态变化是了解神经信息处理核心机制的关键所在。为了可视化这种精细结构并追踪其动态过程,本文对斑马鱼的运动神经元进行了约120分钟的连续动态成像(图2)。图2(A)对比了像差校正前后,210-230微米深处运动神经元的成像结果,对应的频域分布图像如图2(B)所示,空间频率分量的恢复表明,通过像差校正和超分辨图像重构提高了空间分辨率。轴突上模糊的形态突起变化在像差校正和超分辨图像处理之后变得更清晰(图2C)。值得注意的是,突起和轴突之间的连接结构在宽场图像中是观察不到的,但在经过像差校正的超分辨图像中非常明显。在对神经元时间序列成像中可以观察到,0分钟时,突起(白色箭头)与轴突由两根纤细丝状体相连;60分钟左右,突起的形态发生了明显变化,并在120分钟形成新的突起。实验结果证明,基于自适应光学校正的双光子多焦点结构光照明显微成像技术在活体大深度超分辨显微成像中有很大潜力,可以实现神经元纤细丝状体精细结构的动态可视化。

图2.活体斑马鱼运动神经元结构变化动态监测。(A)像差校正以及多焦点结构光照明对成像的提升效果对比。比例尺:5微米。(B)频域分布图中量化像差校正和超分辨重构对成像分辨率的改善。(C)A图中紫色箭头所指结构的时间序列成像结果。比例尺:2微米。
该研究得到了国家重点研发计划、国家自然科学基金、深圳市重点实验室组建项目和深圳市科技计划基础研究的支持。
论文原文链接:https://photonix.springeropen.com/articles/10.1186/s43074-023-00115-2